【转载】植物病害防治新突破:超分子抗细菌生物膜的创新应用
2025-09-26 浏览次数: 10
植物病害防治新突破:超分子抗细菌生物膜的创新应用
贵州大学绿色农药国家重点实验室王培义教授团队在Nature Communications(IF 15.7/JCR Q1)发表题为“A supramolecular bactericidal material for preventing and treating plant-associated biofilms”的研究论文,该研究针对植物细菌生物膜引发的抗性以及药剂在叶片上附着性差的问题,创新性的使用磷酸/异丙醇胺修饰的二茂铁与β-环糊精(β-CD)形成的主客体复合物,开发了一种拥有层状超分子结构的材料。该材料可增强在叶片上的滞留能力,还通过靶向作用于生物膜,大幅提升了对多种细菌性病害(如细菌性叶枯病、细菌性条斑病和柑橘溃疡病)的防控效果。该研究成果为植物细菌性病害的预防与管理提供了全新的思路和技术手段,展现了广阔的应用前景

1、细菌生物膜对农业的威胁
细菌生物膜保护细菌,使其能够抵抗植物免疫和杀菌剂,导致农作物减产20%-40%。
迫切需要开发既能抑制生物膜形成又能清除已有生物膜的高效杀菌剂。
2、生物膜清除的主要挑战
杀菌剂活性成分在叶片表面扩散和吸收效率低,限制效果。
水稻叶片的超疏水特性(如蜡质层和绒毛)使液滴易反弹或滚落,难以实现有效覆盖。
现有改进剂型(如纳米乳液、微胶囊)虽有一定效果,但存在高成本、复杂工艺及环境问题(如土壤退化和有害化合物积累)。
3、超分子化学的潜力
超分子化学通过主-客体相互作用提供创新杀菌剂设计策略,兼具环境可持续性和生态相容性。
环糊精(CDs)作为主体分子,可包封活性成分;二茂铁及其衍生物作为客体分子,具有抗菌、抗病毒等药理特性。
磷酸盐和异丙醇胺修饰的二茂铁可能产生协同抗菌效果,增强与环糊精的相互作用,干预生物膜并提高生物利用度。
4、新型超分子杀菌剂FcP15@β-CD的优势
结合主体分子β-环糊精与客体分子磷酸盐/异丙醇胺修饰的二茂铁,形成高效超分子抗菌材料。
该材料在植物叶片上表现出优异的物理化学性质和生物相容性,能有效抑制和清除生物膜。
实验表明,FcP15@β-CD对水稻白叶枯病、水稻细菌性条斑病和柑橘溃疡病的防治效果优于市售杀菌剂噻唑锌和单独使用FcP15。
核心要点:
该研究提出了一种基于超分子化学的创新杀菌剂FcP15@β-CD,通过主-客体相互作用显著增强了对细菌生物膜的控制能力,为农业细菌性病害的防治提供了新的解决方案✨。
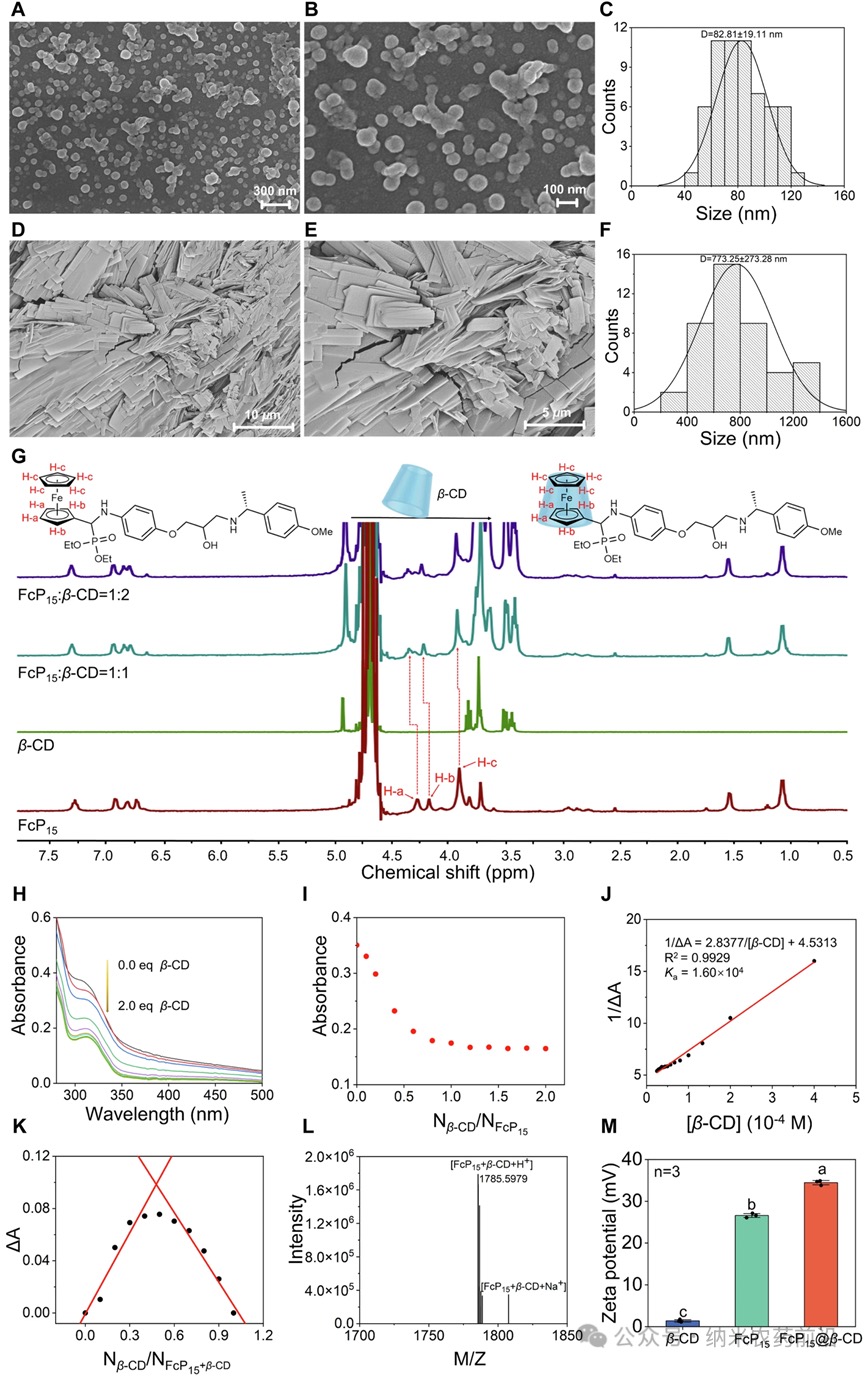
图1 A、B:FcP15的SEM图像。C:FcP15的粒径分布。D、E:FcP15@β-CD的SEM图像。F:FcP15@β-CD的粒径分布。G:FcP15、β-CD以及FcP15与β-CD在D₂O中摩尔比为1:1和1:2的混合物的¹HNMR光谱,FcP15浓度为5.0mM。H:在β-CD摩尔当量逐渐增加(0-2.0eq)的情况下,FcP15(0.1mM)的UV-vis滴定曲线。I:FcP15在315nm处的吸收光谱相对于不同浓度β-CD的线性关系。J:1/ΔA与1/β-CD的Benesi-Hildebrand图。K:在水相中,FcP15和β-CD浓度均设为0.1mM时,315nm处ΔA的连续变化Job图。L:FcP15@β-CD的高分辨率质谱图。M:水溶液中FcP15@β-CD、FcP15和β-CD的zeta电位测量结果。
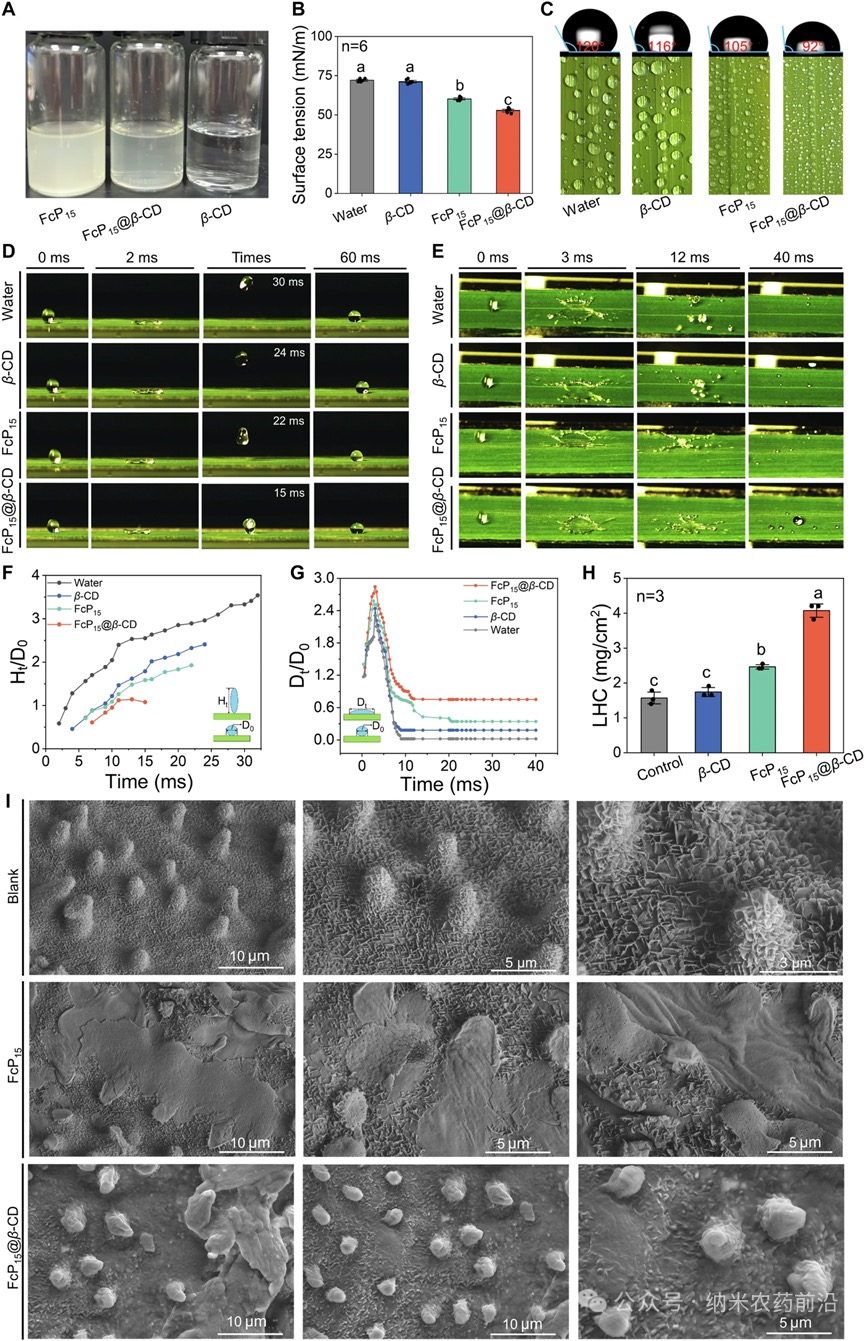
图2 AFcP15、FcP15@β-CD和β-CD水溶液的图像。B200μg/mL的水、β-CD、FcP15和FcP15@β-CD水溶液的表面张力测量结果。C200μg/mL的水、β-CD、FcP15和FcP15@β-CD水溶液的接触角测量结果。D液滴从10cm高度滴落在水稻表面的反弹行为图像。E液滴从35cm高度滴落在水稻表面的飞溅行为图像。F在液滴反弹测试中,包括水、β-CD、FcP15和FcP15@β-CD液滴在内的水溶液的归一化液滴接触直径(Ht/D0)随时间的变化。G在液滴飞溅测试中,包括水、β-CD、FcP15和FcP15@β-CD液滴在内的水溶液的归一化接触直径(Dt/D0)随时间的变化。H水稻叶片浸入不同溶液后的持液能力。I未经处理的水稻叶片、经FcP15处理的水稻叶片和经FcP15@β-CD处理的水稻叶片的扫描电子显微镜图像。
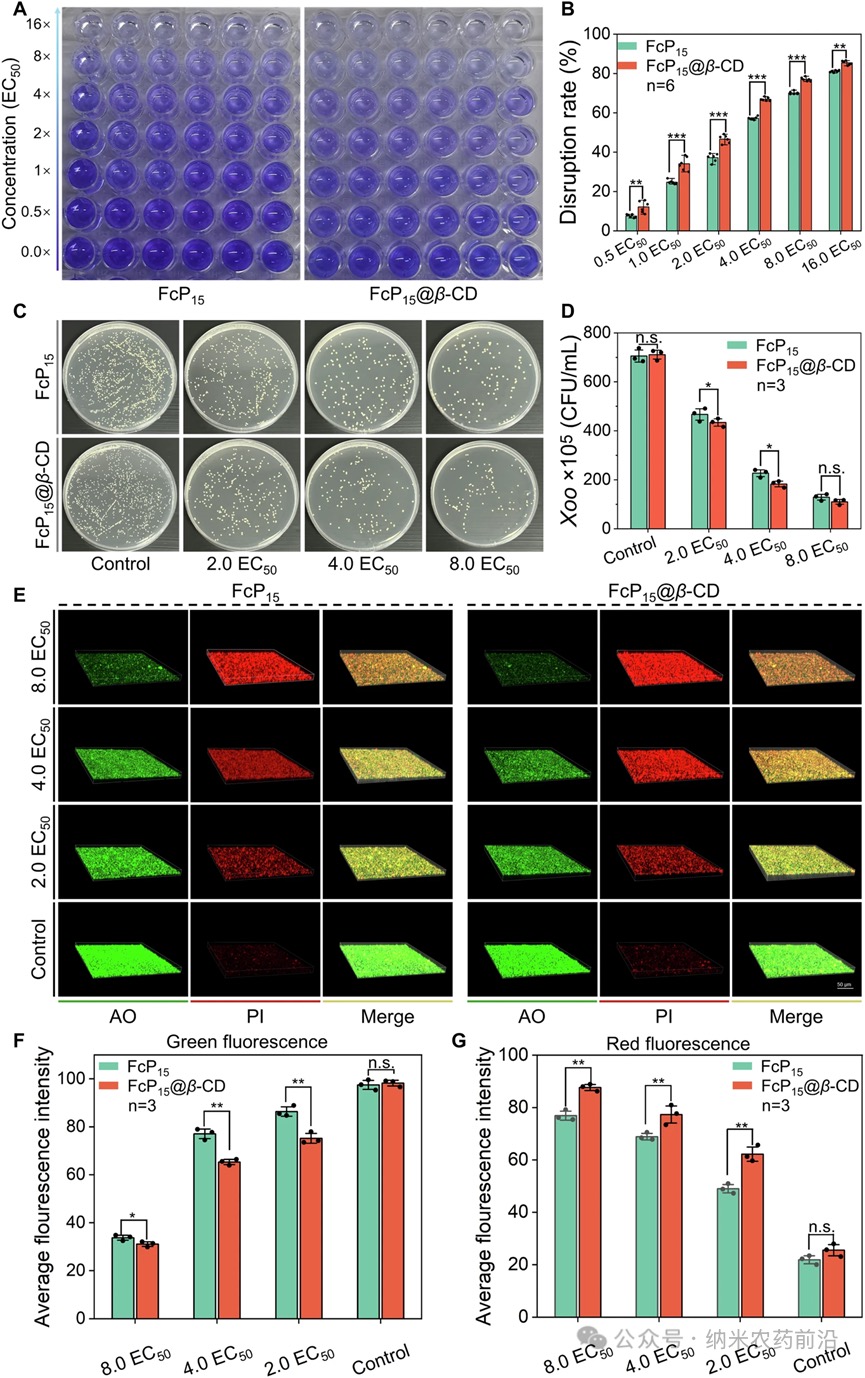
图4 A使用结晶紫染色评估预先形成的生物膜的图像。B暴露于不同剂量的FcP15和FcP15@β-CD后,预先形成的水稻白叶枯病菌(Xoo)生物膜破坏情况的量化。C暴露于不同浓度的FcP15和FcP15@β-CD后,在固体NA培养基上已形成的生物膜内Xoo菌落的生长情况。D对琼脂平板上的Xoo菌落进行定量评估。E暴露于不同浓度的FcP15和FcP15@β-CD后,已形成的生物膜中Xoo群落的三维共聚焦激光扫描显微镜(CLSM)图像。生物膜细胞依次用吖啶橙(AO,绿色:活细胞)和碘化丙啶(PI,红色:死细胞)染色,比例尺为50μm。F、G使用Image-J软件对上述CLSM三维图像中的活(绿色荧光区域)和死(红色荧光区域)Xoo群落进行计数。在(B、D、F、G)中,误差线表示平均值±标准误差(SE)。
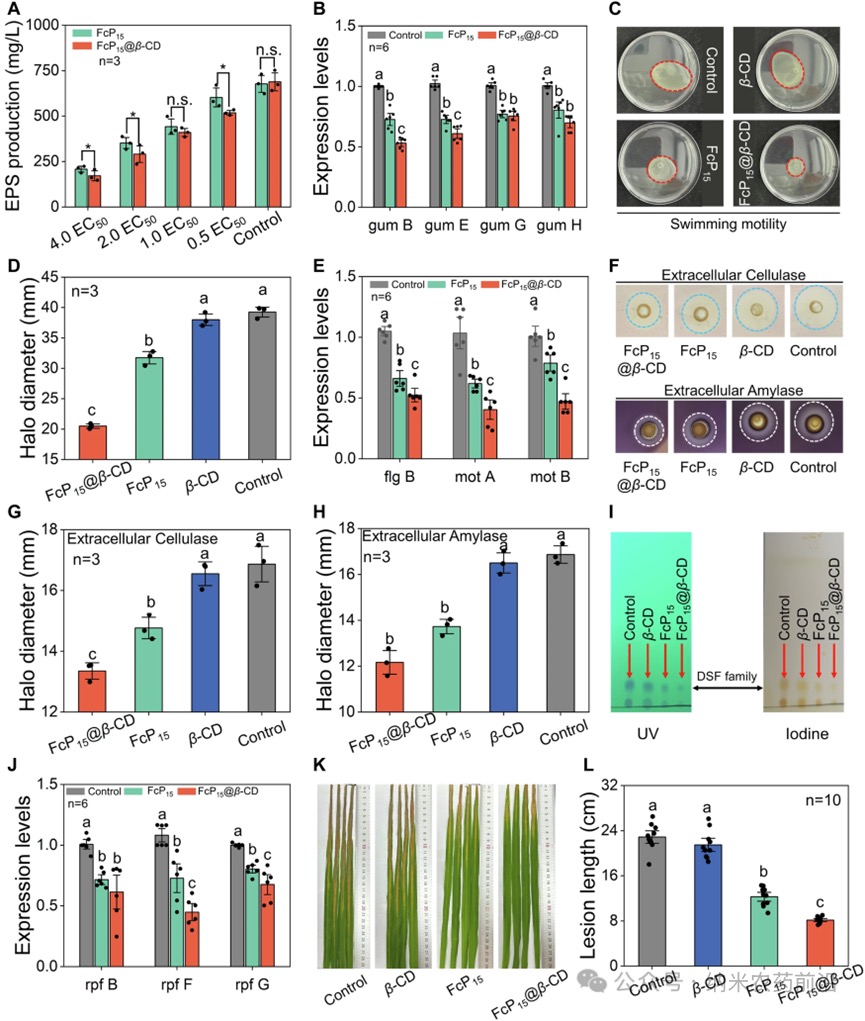
图7 A不同浓度(从0.5到4.0×EC50)的FcP15和FcP15@β-CD对胞外多糖(EPS)产量的诱导作用。B用2.0×EC50的FcP15和FcP15@β-CD处理后,水稻白叶枯病菌(Xoo)中与EPS合成相关的gum基因的表达水平。C用β-CD、FcP15和FcP15@β-CD处理后Xoo的泳动能力测定及D相应的泳动圈直径。E用2.0×EC50的FcP15和FcP15@β-CD处理后,与Xoo泳动能力相关的基因表达。F展示胞外纤维素酶和胞外淀粉酶活性的图像,以及用FcP15@β-CD、FcP15和β-CD处理后G胞外纤维素酶和H淀粉酶的圈直径。I用培养液上清液提取可扩散信号因子(DSF),然后通过薄层层析(TLC)进行分析,并在254nm紫外光下和碘缸中显色观察。J用2.0×EC50的FcP15和FcP15@β-CD处理后,Xoo中参与DSF产生的rpf基因的表达。K用剪叶接种法使Xoo侵染水稻叶片,并用浓度为8.90μg/mL的β-CD、FcP15和FcP15@β-CD处理的代表性图像。L上述致病性测定中叶片病斑长度的量化结果。
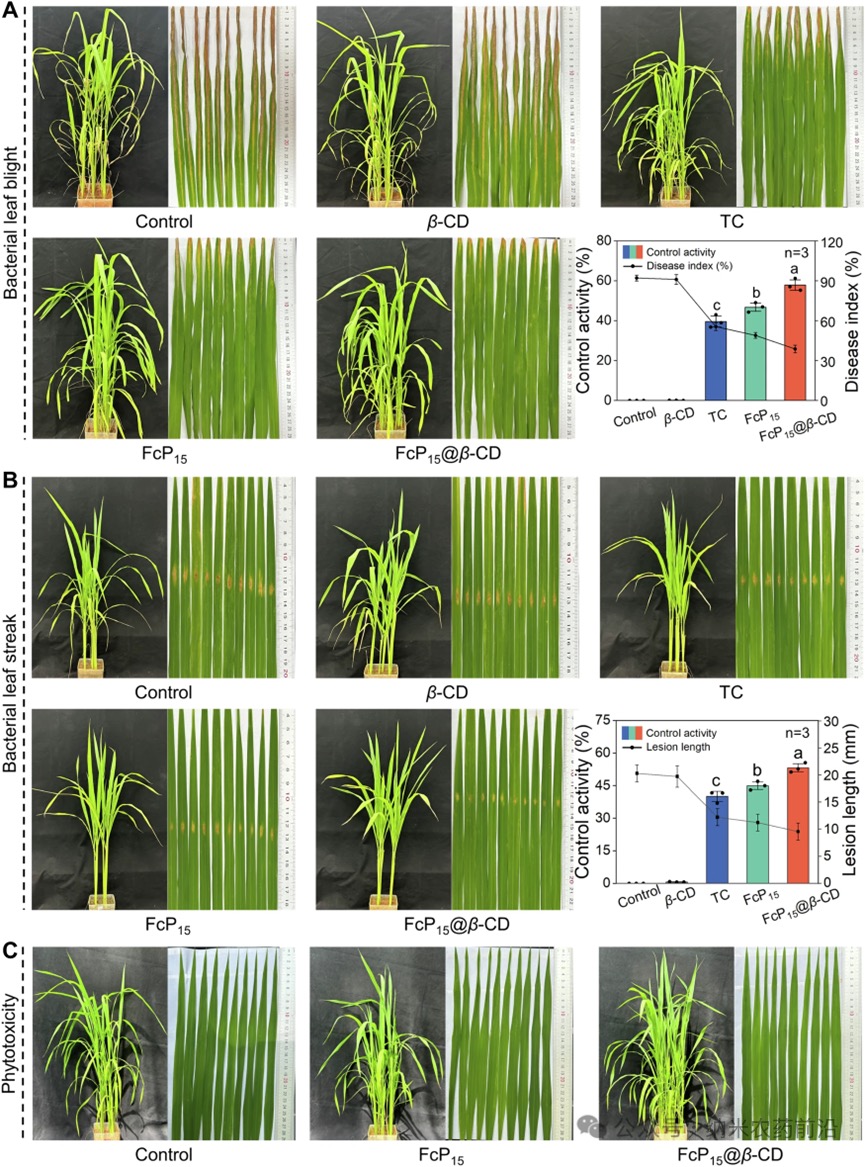
图8 A.200μg/mL的FcP15、FcP15@β-CD和市售杀菌剂TC对水稻白叶枯病体内疗效的摄影记录与评估。B.200μg/mL的FcP15、FcP15@β-CD和TC对水稻细菌性条斑病体内疗效的可视化展示与评估。C.500μg/mL的FcP15和FcP15@β-CD对水稻植株的药害评估。
原文链接:https://doi.org/10.1038/s41467-025-57839-x