ACS Nano丨贵州大学王培义:一种基于低共熔溶剂的纳米递送系统用于增强稻瘟病治疗
2025-07-02 浏览次数: 10
气候变化对人类社会和食品系统造成了前所未有的重大危机。农药在全球粮食安全和生物灾害防治中至关重要,因其能有效减少全球每年30-40%的作物损失。然而,在农药施用过程中,常伴随漂移、径流和泄漏等问题,导致仅有1-25%的农药能到达目标作物,其中仅0.1%的活性成分能真正作用于目标。这意味着大部分农药释放到环境中,可能对生态系统造成危害,污染环境,并导致农药抗性问题。因此,开发高效农药需同时关注关键靶点和有效的递送方式。
稻瘟病由稻瘟菌(Magnaporthe oryzae)引起,是水稻最具破坏性的病害之一,会导致植株萎蔫和严重减产。化学农药常用于疾病控制,但水稻叶片超疏水表面显著降低了农药的附着和沉积效果,限制了其效能。近期研究聚焦于靶向稻瘟菌的关键毒力因子,如漆酶——一种微生物多酚氧化酶,对二羟基萘(DHN)黑色素的生物合成至关重要。这种黑色素不仅帮助真菌侵入水稻组织,还促进了其致病性、形态发生和防御机制。因此,抑制漆酶被认为是开发抗真菌策略的有前景方向。有研究学者指出,漆酶抑制剂(如PMDD-5Y)可干扰黑色素生成,从而抑制真菌毒力和感染。因此,深入探索漆酶抑制剂可为稻瘟病管理提供针对性且可持续的解决方案。
除了开发靶向农药,纳米农药技术也成为提升农药效率的有前景方法。纳米颗粒因其高比表面积可显著改善农药在目标作物上的附着和扩散,从而提高农药利用率,降低施用量,并克服传统制剂的局限性。当前纳米农药研究主要集中在两种策略:一是通过前药设计或分子自组装开发最小化载体纳米农药(NMCs),优化递送效率;二是利用低共熔溶剂——一种通过氢键驱动自组装形成的、由两种或三种生物相容性组分构成的成本效益高的体系。将靶向特异性农药(如漆酶抑制剂)与这些先进纳米制剂结合,可协同提高生物利用度,同时保持药效。这种综合策略可能代表下一代农药开发的变革性范式。
本研究提出,将高效漆酶抑制剂与低共熔溶剂体系整合,不仅能有效促进植物生长和控制稻瘟病,还能最大化农药利用效率。本研究基于上述假设开展了以下实验:首先,通过前药技术对4-羟基苯甲酸辛酯(OP)进行结构修饰,合成了4-膦酰氧基苯甲酸辛酯(POP),该化合物在环境中稳定,但在体内可通过碱性磷酸酶(ALP)快速水解。其次,将POP与氯化胆碱结合形成低共熔溶剂,确保生物降解性、生物相容性和促植物生长效果。随后,将基于PMDD-5Y设计的漆酶抑制剂A12(其系列中活性最高)溶于低共熔溶剂中,并通过水稀释制备了水基纳米递送系统A12@DES。最后,系统评估了A12@DES的性能,表明其在提高农药生物利用度的同时,能有效抑制稻瘟病,展现了双重功能。
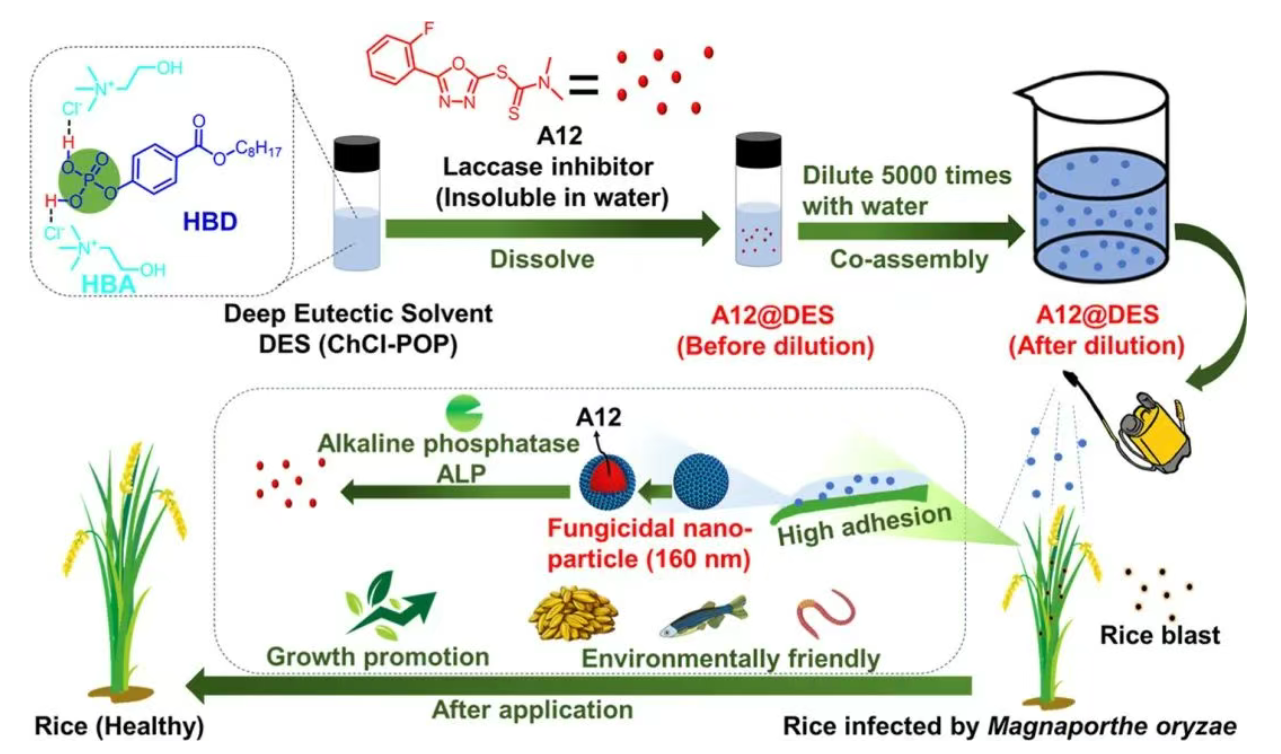
方案 1.水基纳米递送系统制备方案示意图,该系统用于一种生物活性的漆酶抑制剂 A12,其具有出色的叶片亲和力,可有效控制稻瘟病。
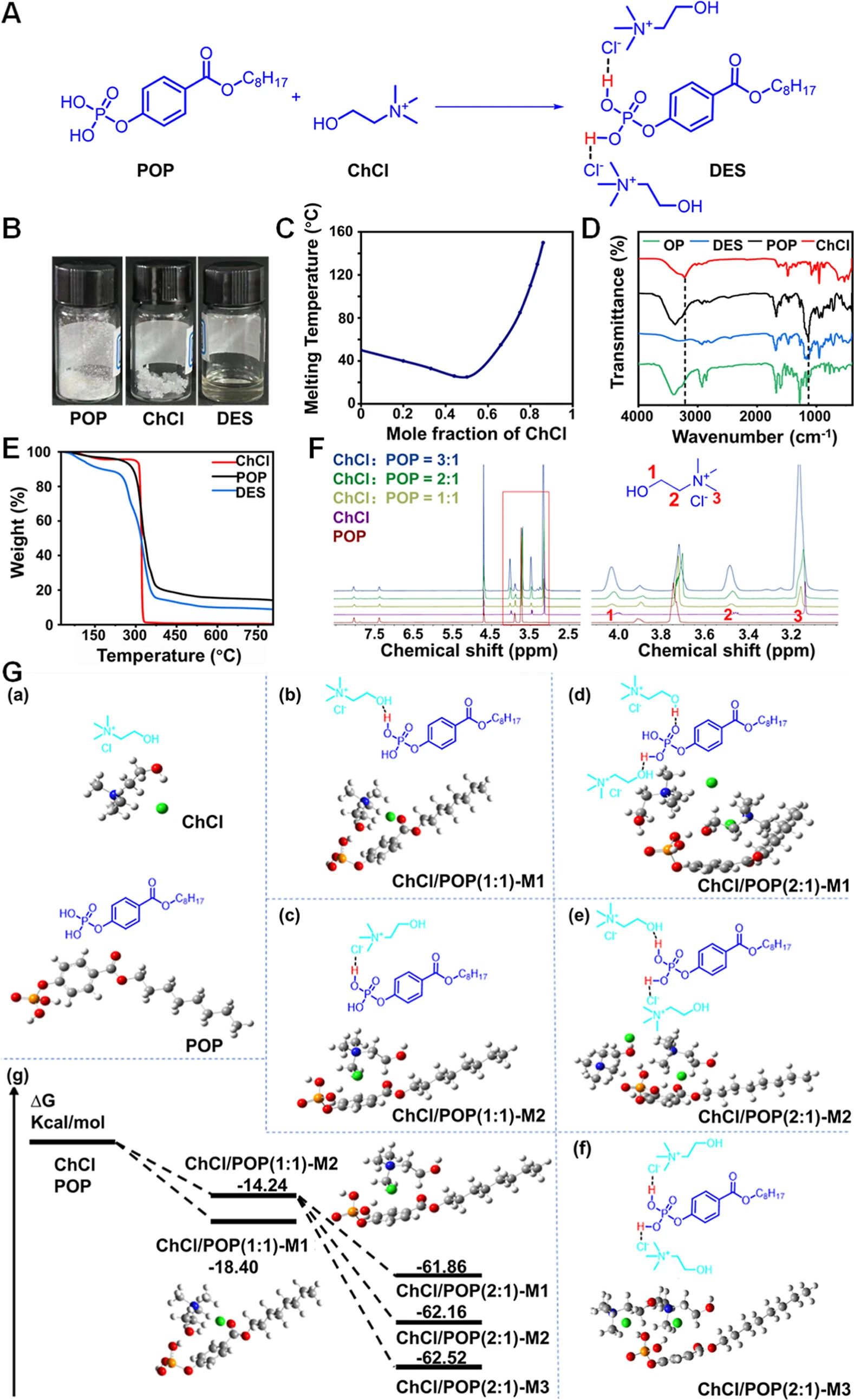
图 1.DES的表征及特性。(A)ChCl、POP和 DES的化学结构。(B)ChCl、POP和 DES的照片。(C)所制备的 DES的固液相图。(D)ChCl、POP、DES和 OP的傅里叶变换红外光谱。(E)在氮气环境下以 10°C·min-1的升温速率进行的热重分析。(F)不同摩尔比(3:1、2:1和 1:1)的 POP、ChCl和 ChCl-POP(DES)在 D2O中的 1H核磁共振光谱。(G)DES中存在的单体和复合物的 DFT计算:(a)单体化合物ChC)和POP、(b)ChCl/POP(1:1)-M1、(c)ChCl/POP(1:1)-M2、(d)ChCl/POP(2:1)-M1、(e)ChCl/POP(2:1)-M2、(f)ChCl/POP(2:1)-M3以及(g)上述模型的吉布斯自由能(ΔG)。
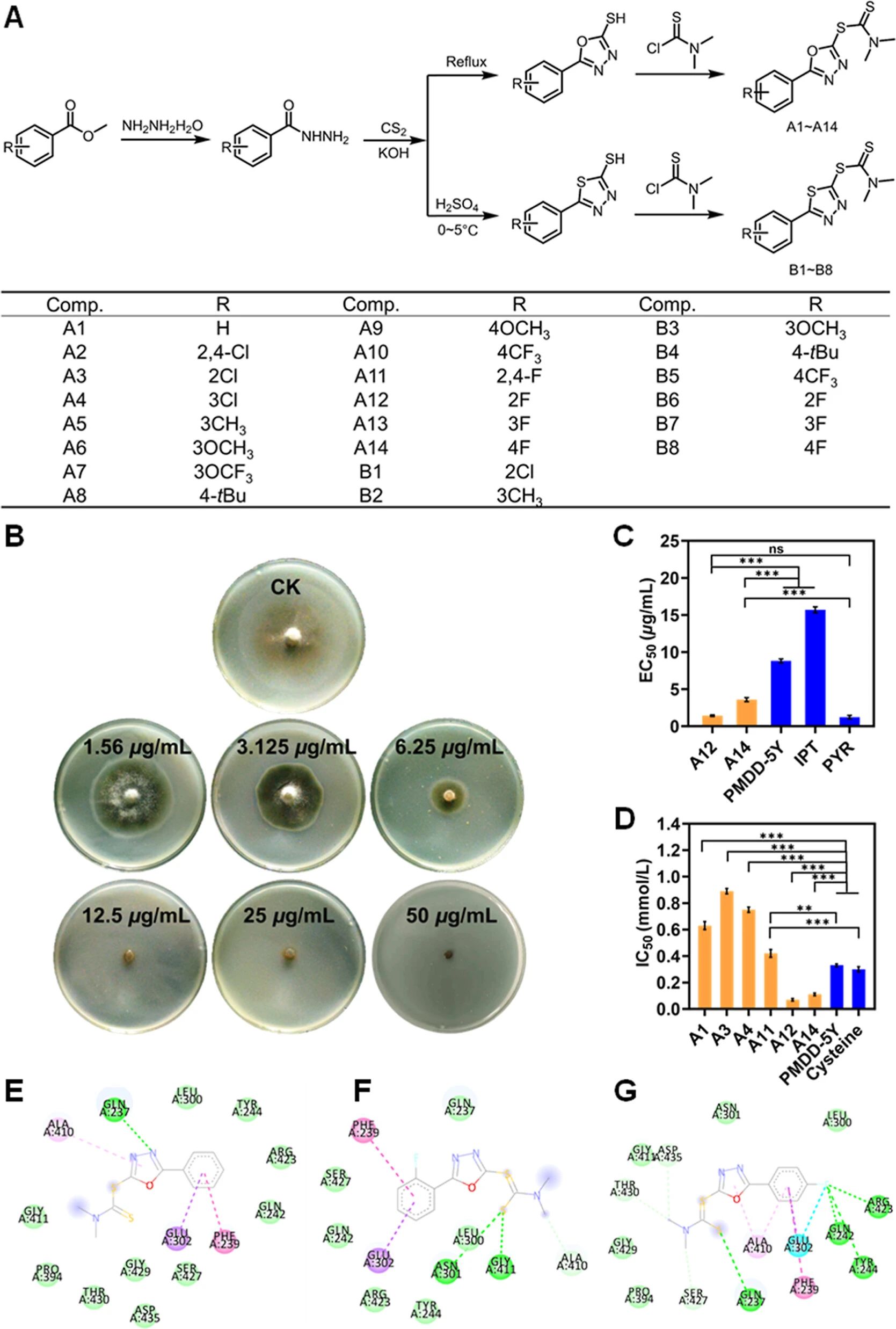
图 2.黄铜素抑制剂的合成、体外活性、酶活性测定及分子对接分析。(A)目标化合物的通用合成路线。(B)A12对稻瘟病菌的抑制效果。(C)对稻瘟病菌体外具有高生物活性的化合物的 EC50值(微克/毫升)。(D)目标化合物对黄铜酶体外的 IC50值(毫摩尔/升)。对于(C、D),采用单因素方差分析(ANOVA)并结合图德氏 HSD检验(n ≥ 3,ns:无显著差异,*p < 0.05,**p < 0.01,***p < 0.001)来确定显著差异。(E-G)A1、A12和 A14与黄铜酶的结合模式(PDB编码号:1KYA)。
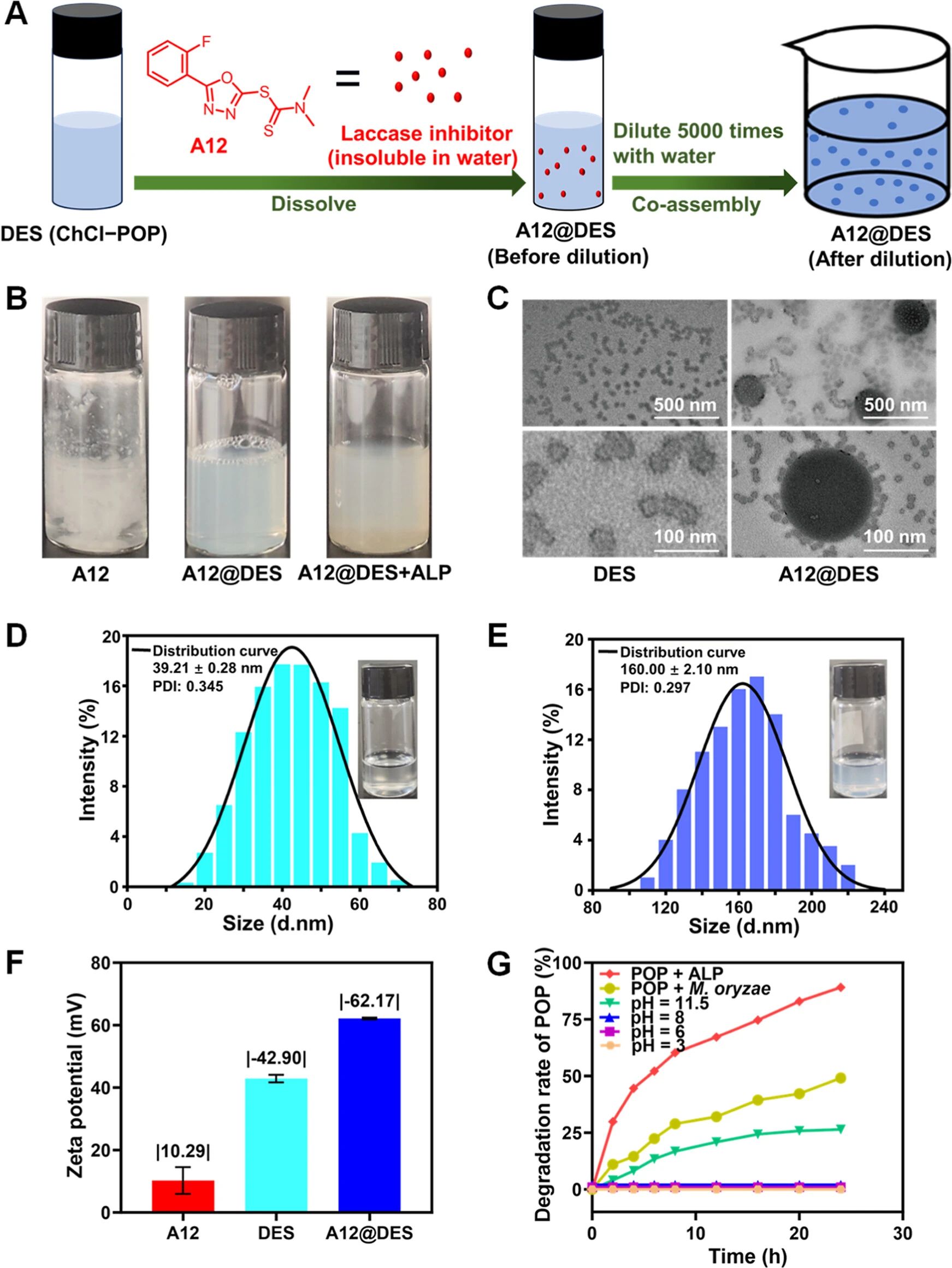
图 3.A12@DES的特性分析。(A)载有 A12的 DES纳米递送杀虫剂系统的示意图(A12@DES)。(B)在无 DES的情况下、在有 500 μg/mL的 DES的情况下以及在有 500 μg/mL的 DES并添加 ALP 24小时后,200 μg/mL的 A12在水中的图片。(C)DES和 A12@DES的 TEM图像。(D)500 μg/mL的 DES的外观和粒径分布。(E)A12@DES(A12为 200 μg/mL,DES为 500 μg/mL)的外观和粒径分布。(F)A12、DES和 A12@DES的 Zeta电位。(G)在不同条件下的 POP稳定性。
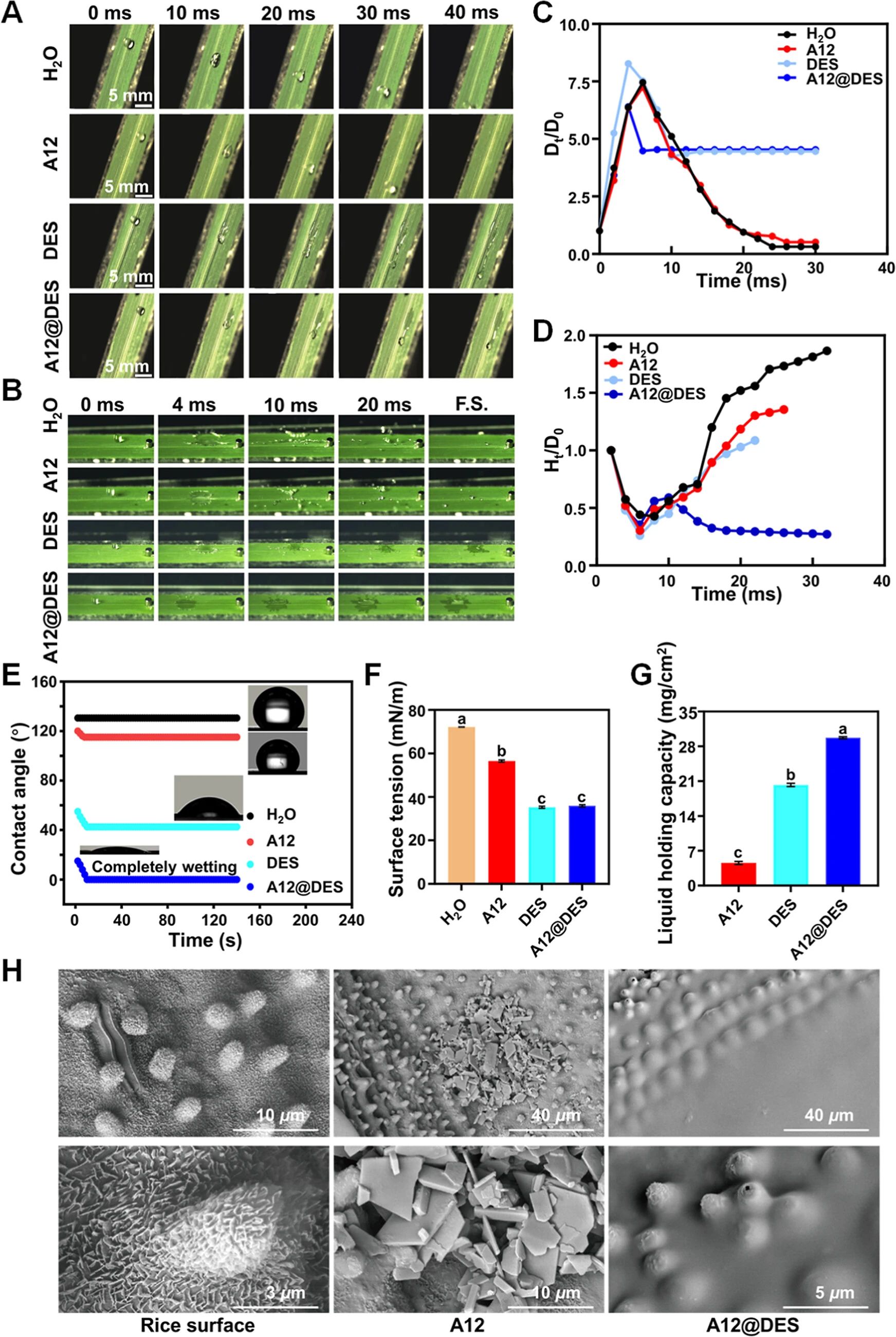
图 4. A12@DES在水稻表面的沉积性能。(A)从 10.0厘米高度、以 60°倾斜角度拍摄的水滴、A12、DES和 A12@DES在水稻叶片上滑动的高速摄像图像。(B)不同水滴在水稻叶片上的撞击行为,从 40.0厘米高度(F.S.:最终状态)拍摄。(C)以初始直径为参照的水滴膨胀直径(Dt/D0)。(D)以初始直径为参照的水滴反弹高度(Ht/D0)。(E) 140秒内水滴在水稻叶片表面的接触角值。(F)水的静态表面张力、A12、DES和 A12@DES的表面张力(A12为 200微克/毫升,DES为 500微克/毫升;n = 3,ANOVA;Tukey's HSD;p < 0.05)。(G)A12、DES和 A12@DES在水稻叶片表面液体保持能力(LHC)的统计分析(n = 20;ANOVA;Tukey's HSD;p < 0.05)。(H)未经处理的水稻叶片以及用 A12或 A12@DES处理过的水稻叶片的扫描电子显微镜图像(A12为 200微克/毫升,DES为 500微克/毫升)。
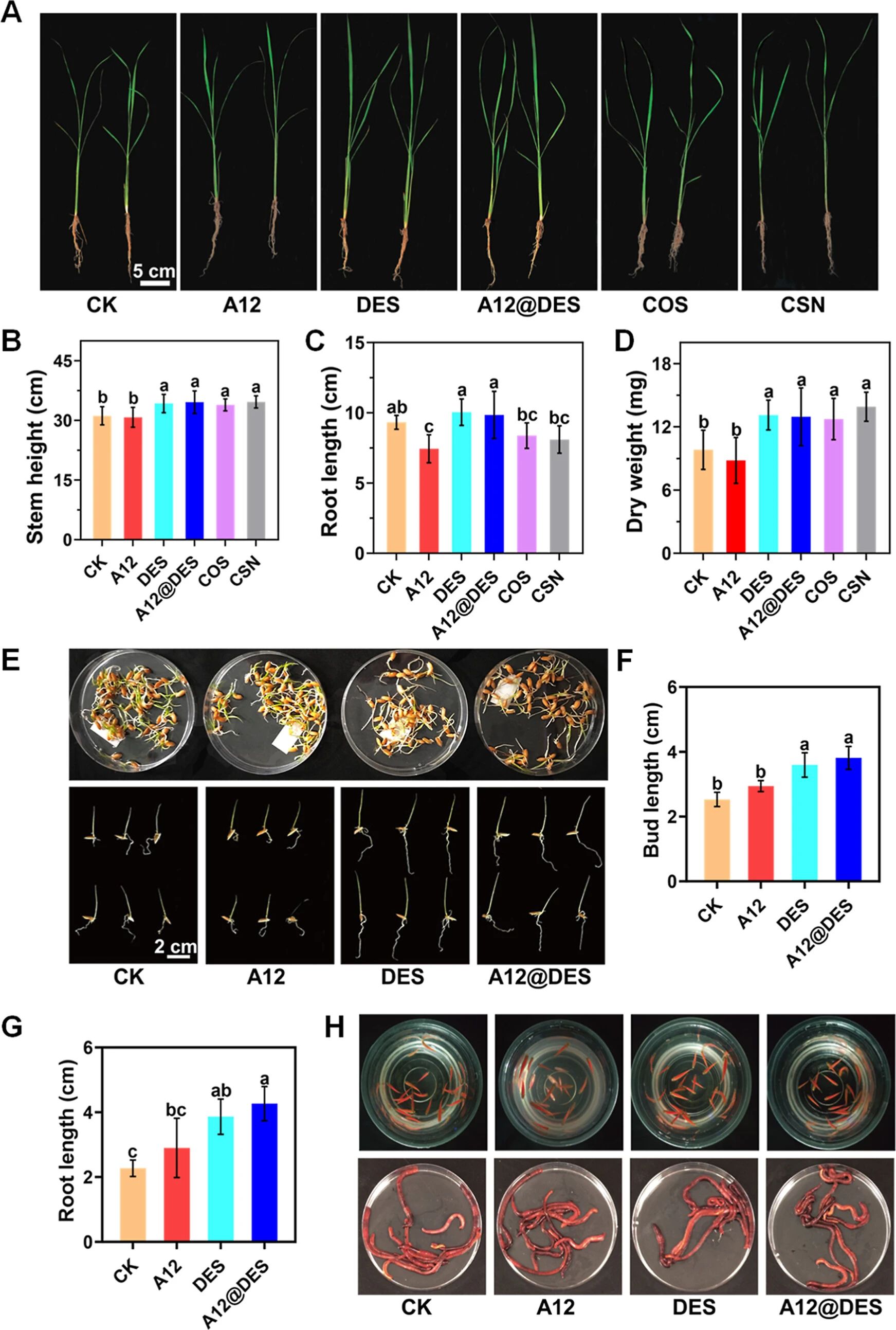
图 5. A12@DES的生物安全性。(A)A12、DES以及 A12@DES(A12浓度为 200微克/毫升,DES浓度为 500微克/毫升)对水稻生长和茎高(B)、芽长(C)以及干重(D)的影响。(B)阳性对照:寡糖类物质(COS;50微克/毫升)和硝基苯磺酸钠(CSN;50微克/毫升)。(E)A12、DES以及 A12@DES(A12浓度为 20微克/毫升,DES浓度为 50微克/毫升)对水稻种子发芽以及芽长(F)和根长(G)的影响。测量数据采用单因素独立方差分析,多次进行 Tukey's HSD比较,差异显著的 p值小于 0.05。(H)A12、DES和 A12@DES(A12浓度为 20微克/毫升,DES浓度为 50微克/毫升)在与斑马鱼和蚯蚓共培养 96小时后对它们的急性毒性测试结果。
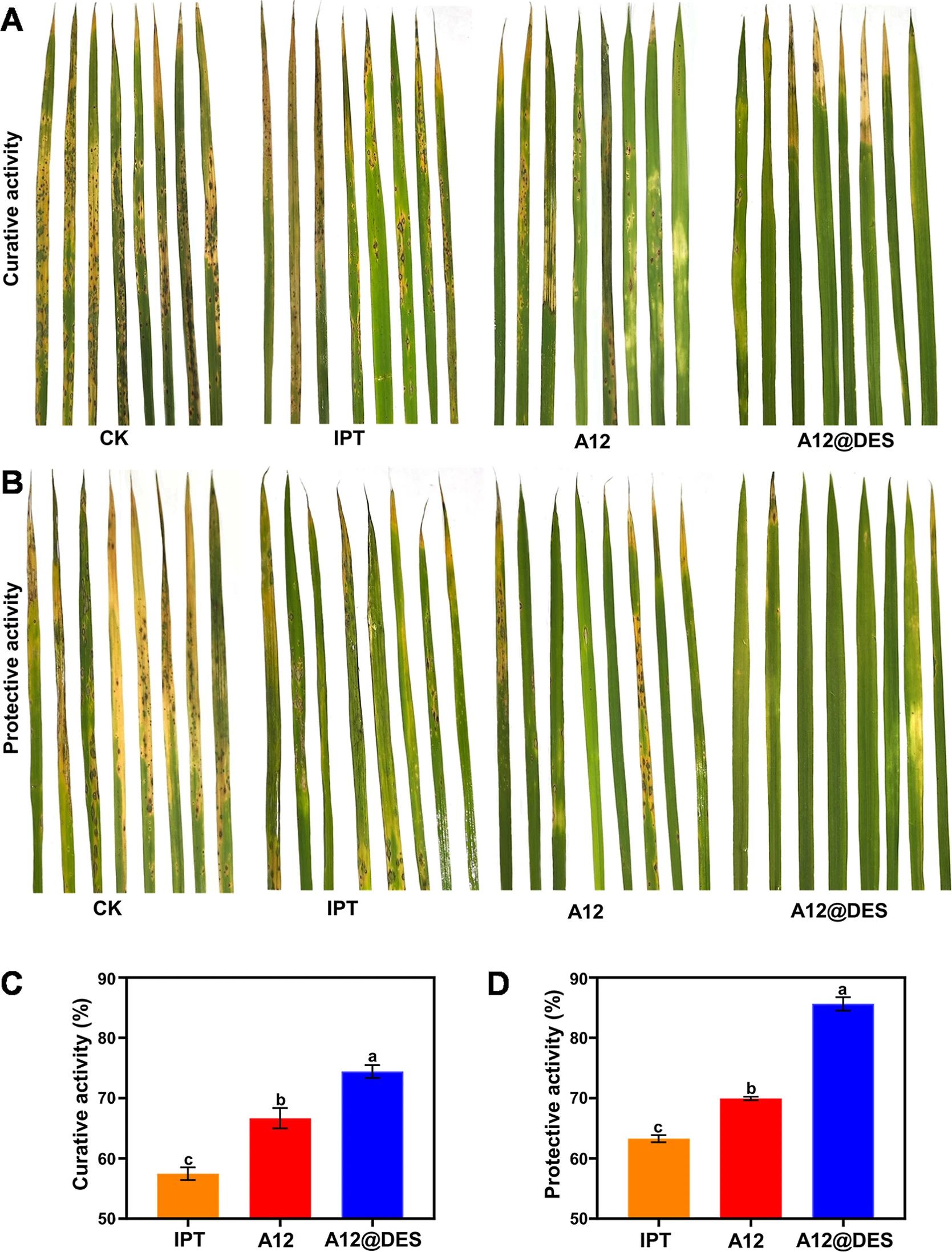
图 6. A12@DES的体内抗真菌活性。(A)A12@DES对稻瘟病菌在水稻中的治疗效果和(B)防护效果的图片。(C)基于上述图片得出的治疗效率和(D)防护效率(n = 8,每个对照组有 3个花盆,每个花盆包含 4株水稻;方差分析;图德氏 HSD法;p < 0.05)。CK:阴性对照;IPT:异丙硫醇胺,200 μg/mL。A12:以 200 μg/mL处理;A12@DES:以 200 μg/mL的 A12与 500 μg/mL的 DES一起处理。