Angew:离子型氢键辅助的氮立体中心构建
2024-05-22 浏览次数: 234
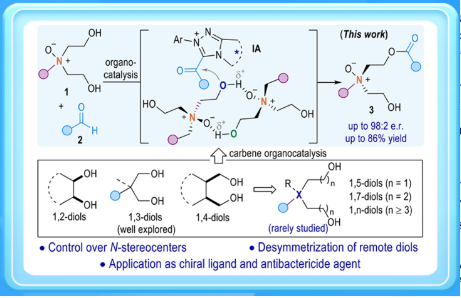
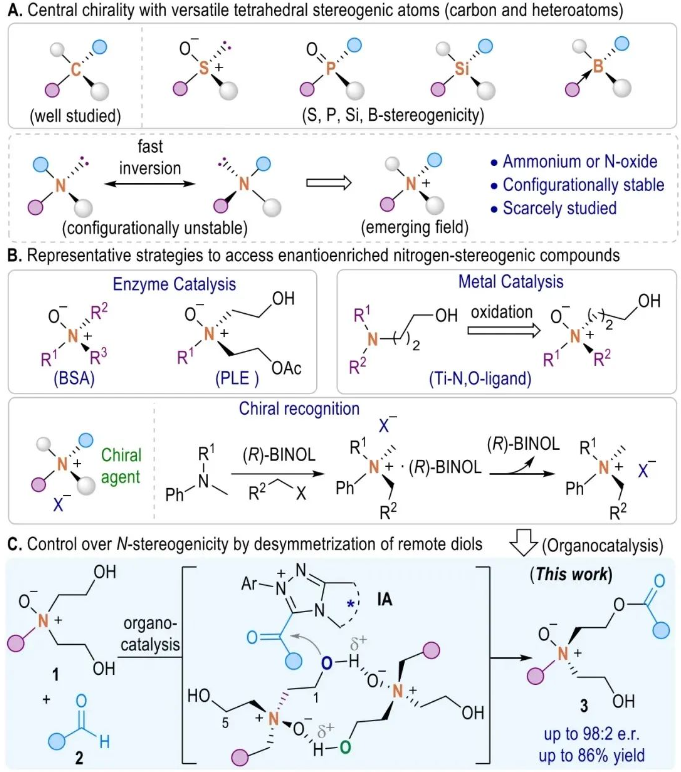
有杂原子立体中心的化合物在手性配体、材料、催化剂和药物等领域有广泛的应用。近年来,构建含有硫、磷、硅和硼等杂原子立体中心的方法已经得到广泛发展(图1A)。然而,与磷同一主族的氮中心手性化合物合成报道较少,其主要原因是氮原子上的孤对电子可以自由翻转,导致其构型迅速消旋,给氮手性化合物合成带来了巨大挑战。目前已报道的氮立体中心不对称构建策略主要包括两种方法:一种是将氮原子置于刚性分子骨架中以此来稳定氮立体中心;另一种策略是通过合成季铵化合物(胺类N-氧化物、N-中心金属配位和N-中心季铵盐)来阻止快速翻转以增强N(V)中心构型的稳定性。根据文献报道,制备手性N(V)中心化合物的方法包括利用牛血清白蛋白(BSA)催化氧化,或者猪肝酯酶(PLE)水解获得光学纯的氮氧化物;此外,2016年Bhadra和Yamamoto报道了一项利用金属钛催化控制三级胺立体选择性氧化得到手性氮氧化物。最近,Kitching等人利用对映体富集拆分剂BINOL来识别铵离子手性中心的策略,为合成手性铵阳离子的对映体提供了有效的途径(Nature, 2021, 597, 70. 图1B)。尽管如此,利用催化剂调控立体选择性地构建氮立体中心化合物仍然极具挑战。
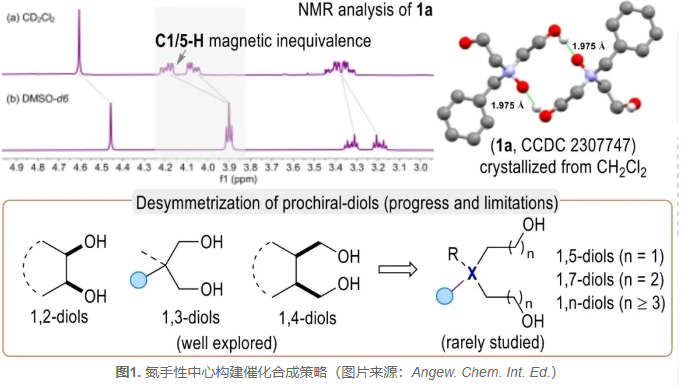
池永贵教授团队专注于在有机合成和绿色药物农药研发生产领域展开创新性工作。近日,池永贵教授团队伍星星利用N-杂环卡宾(NHC)催化氮氧二醇(1,5-或1,7-二醇)去对称化策略,成功开发了一种氮中心手性化合物的催化调控新方法(图1C)。值得一提的是,尽管对映选择性的二醇去对称化反应已经取得了广泛的研究,但大部分方法主要集中在具有1,2-、1,3-和1,4-二醇的对映选择性转换上。针对链长较长(例如1,5-或1,7-二醇)二醇底物的催化去对称化反应仍然是一个巨大的挑战,其原因可能是由于远程二醇的构象灵活以及与手性中心相距较长等因素。在该方法中,作者发现氮氧化物由于存在一类特殊的离子型氢键,在反应溶液中主要以二聚体的形式存在,继而通过手性NHC结合的酰基唑鎓中间体对底物二聚体进行高效的去对称化,获得了一系列高产率、高对映选择性、具有手性四面体结构的氮氧化物,解决了氮立体中心化合物对映选择性合成中所面临的长期挑战。与此同时,所制备的手性N(V)-氧化物可以作为催化剂实现一系列的不对称催化反应,并发现其具有一定的抗菌活性,这对发掘绿色农药活性先导结构具有潜在意义。
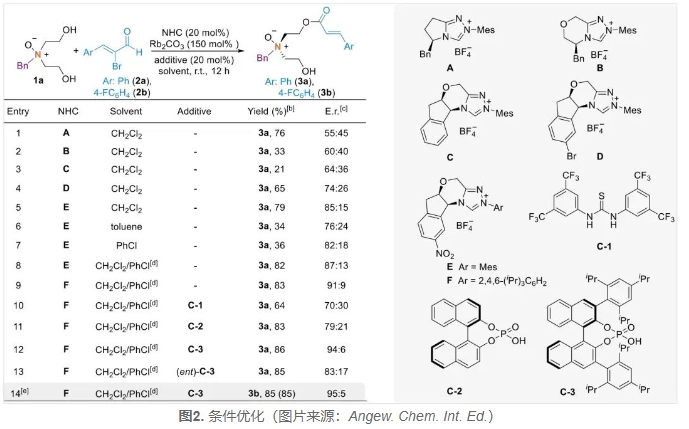
首先,作者以氮氧化物二醇1a和溴代肉桂醛2a为模型底物进行条件优化(图2)。他们首先尝试了多种手性NHC催化剂A-E对控制手性二醇1a的N-立体中心的能力。结果显示,催化剂E在产率和对映选择性方面表现出较好的效果(79%,85:15 er,entry 5)。随后作者对反应溶剂进行了筛选,发现使用CH2Cl2-PhCl混合溶剂可稍微提高产率和选择性(82%,87:13 er,entry 8)。接着,作者尝试使用催化剂F,进一步提高了对映选择性至91:9 er(entry 9 vs entry 8)。在尝试了多种氢键给体和Brønsted酸后,作者确定手性磷酸C-3作为有效的协同催化剂,产物3a的产率和对映选择性显著提高(entry 12,86%,94:6 er)。作者还发现手性Brønsted酸C-3的构型对产物的对映选择性控制起着关键作用。最后,通过使用对氟溴代肉桂醛2b作为底物,作者顺利地得到了高产率和优异对映选择性的产物3b(85%,95:5 er,entry 14)。
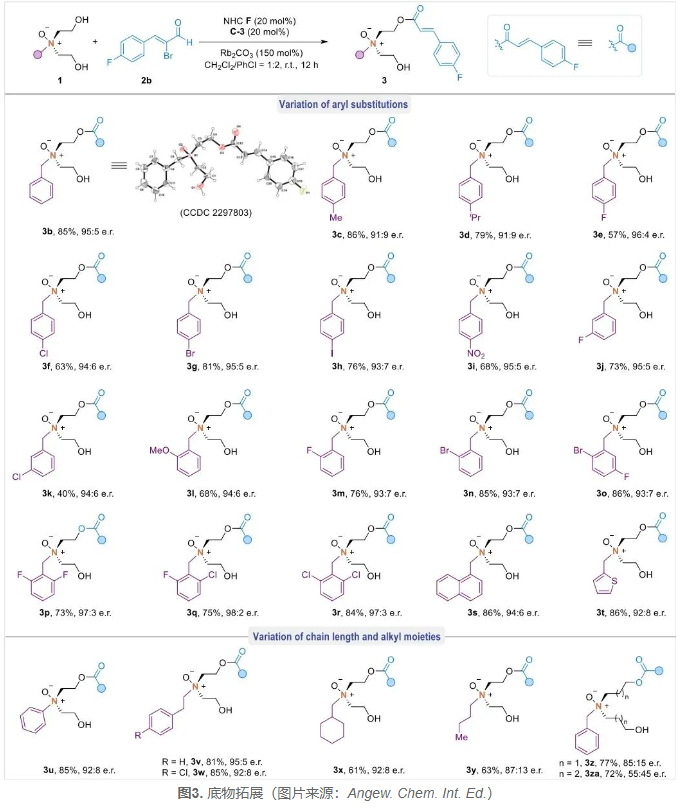
接下来,作者对底物的普适性进行考察(图3),在底物1的芳基部分的对位、间位或邻位上不同的取代基均是兼容的,以40-86%的产率和优异的对映选择性得到手性氮氧化物3b-3n。特别是对于2,6-二取代的氮氧化物3p-3r,其对映选择性较高,如3q(75%,98:2 er)。此外,2-萘基和杂环噻吩基团也以中等产率和较高的对映选择性得到了相应的产物3s-3t。在将苄基替换为苯基或苯乙基后,得到了对应的产物3u-3v,其中,苯乙基产物3v的产率和对映选择性基本上保持不变(81%,95:5 er)。当替换芳基为各种烷基(例如环己烷和丁基)时,在标准条件下所形成的产物3x-3y对映选择性略有降低。最后,作者还考察了烷基醇的链长,发现1,7-二醇骨架的底物也是兼容的;而使用1,9-二醇1za时,得到的产物3za对映选择性较差,可能是因为1,9-二醇与氮中心之间的距离较远。
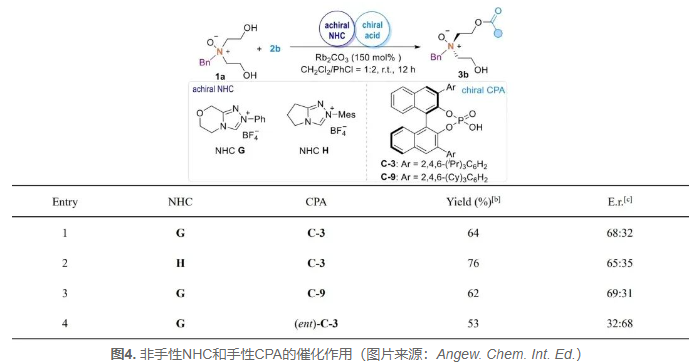
作者设计了一种新的策略,通过手性磷酸在碱性条件下与非手性NHC共同催化构建氮氧化物的方法(图4)。实验结果显示,手性磷酸可能与氮氧化物的二聚体底物发生相互作用,从而增强了对映选择性的控制。这种策略的引入为合成手性氮氧化物提供了新的思路和可能性,有望在不对称合成领域中发挥重要作用。
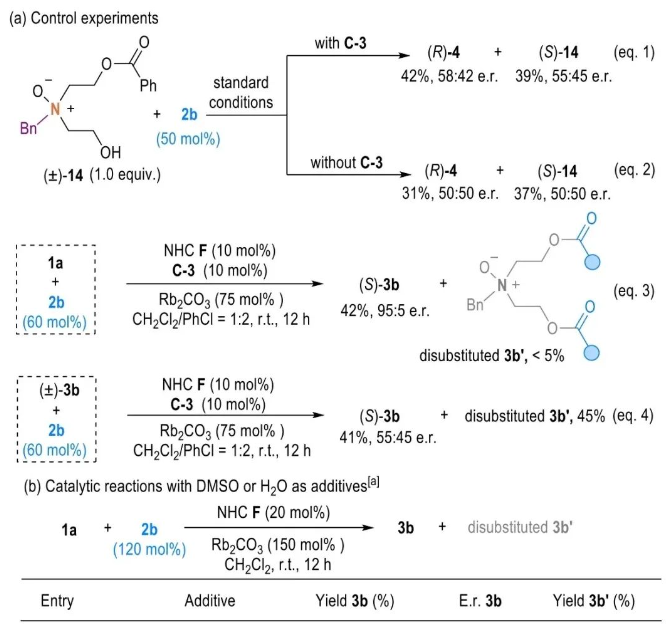
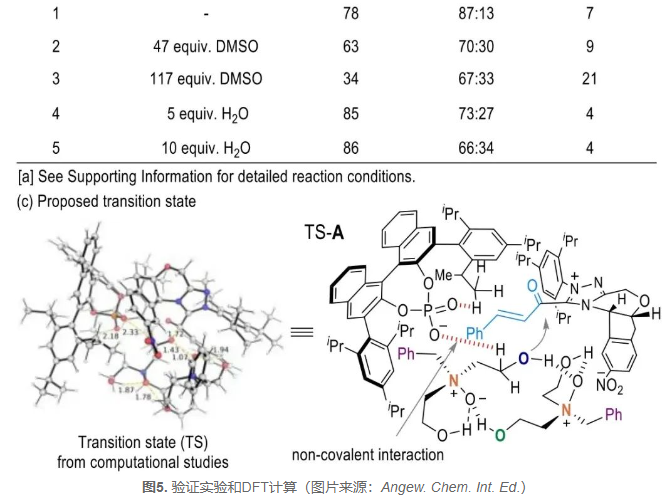
在机理探究方面,作者使用1a羟基单保护底物(±)-14和2b进行了对照反应,结果表明二醇官能团在催化立体控制中起着重要作用(图5a, eq. 1-2)。接着,作者以实验证明通过产物动力学拆分实现对映体富集的可能性较低(图5a, eq. 3-4)。此外,通过晶体学分析观察到底物1a通过两个分子间N+-O‒…HO离子氢键(IHBs)形成了二聚体聚集物(CCDC 2307747,图1C)。IHBs是在离子和分子之间形成的强相互作用的一类特殊的氢键,有时可以达到共价键强度的三分之一。核磁实验显示,在非极性溶剂CD2Cl2中,底物1a中C1/5的氢信号表现出明显的磁不等价,而在高极性的DMSO-d6或D2O溶剂中这些信号的合并峰被检测到。作者通过添加DMSO或H2O等良好的氢键受体进行对照实验,结果显示使用这些受体进行催化反应导致对映选择性值显著降低,表明离子氢键一定程度上受到了破坏(entries 2-5 vs entry 1)。
新加坡科技研究局(A*STAR)章兴龙博士针对这一反应历程进行了DFT计算研究,结果表明导致主要途径的过渡态(TS)涉及酰基唑鎓中间体的羰基碳原子被二聚体聚合物的羟基氧原子从Re面进攻,而不是从Si面进攻,这进一步验证了IHBs在反应中的作用。此外,次要途径的TS涉及Si面进攻而不是Re面进攻。这些理论计算结果有助于解释实验观察到的立体选择性和反应机理,为进一步理解该反应提供了重要的理论依据。
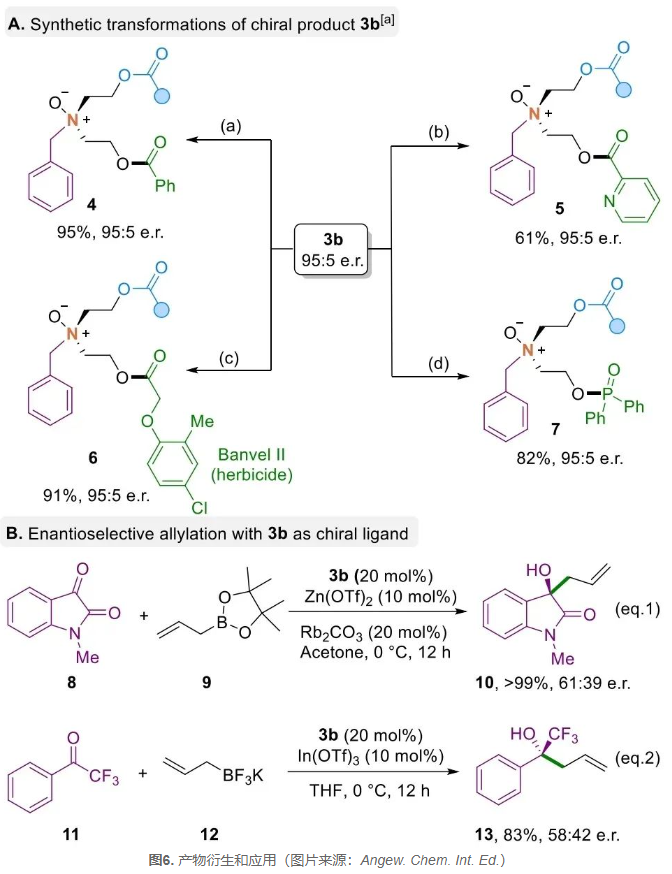
作者对目标产物在合成化学中的应用进行了研究(图6A)。他们发现氮氧化物中的-OH基团可通过简单转化,生成具有潜在配位点和药物活性的手性功能分子。接着,作者还将制备的手性氮氧化物作为手性配体应用于不对称烯丙基化反应中,这一研究展示了氮氧化物在合成化学领域的潜在应用和重要性(图6B)。
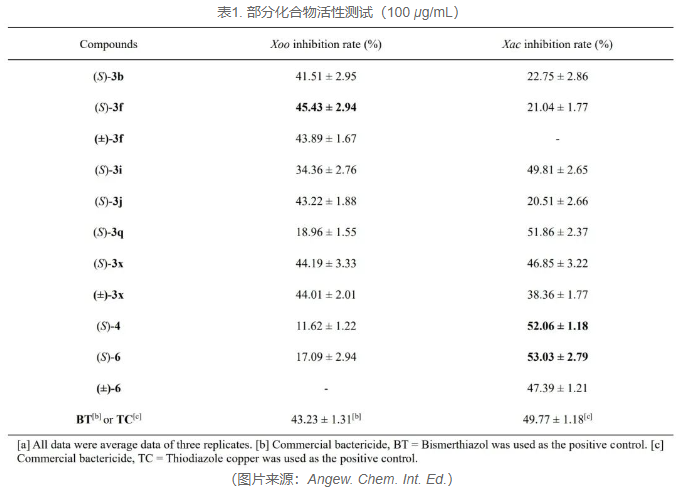
氮氧化物具有多样的生物活性,为此作者随后开展了农药杀菌活性的初步活性筛选(见表1)。针对农业生产中造成重大损失的水稻细菌叶枯病菌Xanthomonas oryzae pv. oryzae(Xoo)和柑橘溃疡细菌Xanthomonas axonopodis. pv. citri(Xac)等植物致病细菌,所制备的氮氧化合物表现出一定的抑制活性。在100µg/mL时,化合物3f的抑制率与阳性药叶枯唑(BT)相当。同时,所得的氮氧化物衍生物表现出了对Xac的良好抑制活性,化合物4和6分别表现出52.06%和53.03%的抑制率,略高于阳性对照杀菌剂噻菌酮(TC)的抑制效力。此外,产物的构型对其生物活性没有显著性影响,但外消旋体(±)-3x和(±)-6对Xoo或Xoc的抑制率略低于其S-异构体。
总结,贵州大学伍星星/池永贵团队成功开发了一种氮中心手性化合物的催化调控新方法。通过NHC结合的酰基咪唑中间体对二聚体聚集物进行去对称化,获得了一系列产率高、对映选择性优异的手性四面体N(V)结构的氮氧化物产物,解决了氮立体中心对映选择性构建的相关难点。此工作近期发表于Angew. Chem. Int. Ed.上。贵州大学绿色农药全国重点实验室、绿色农药与农业生物工程教育部重点实验室二年级博士生罗忠福为论文第一作者。
参见原文:Zhongfu Luo, Minghong Liao, Wei Li, Sha Zhao, Kun Tang, Pengcheng Zheng, Yonggui Robin Chi, Xinglong Zhang*, Xingxing Wu*. Ionic Hydrogen Bond-Assisted Catalytic Construction of Nitrogen Stereogenic Center via Formal Desymmetrization of Remote Diols. Angew. Chem. Int. Ed. 2024, e202404979.